В тази статия ще обърнем внимание върху едно изследване проведено от проф.д-р Лилиан Пароди, което отговаря на въпроса как начина ни на хранене влияе върху стареенето на мозъка.
За да се разбере по-добре този ефект в него е обърнато внимание върху пресимптоматичния период, през който превенцията би могла да бъде най-ефективна. С други думи, да действаме, докато има по-голям смисъл от това или да се замислим над думите “аз 20 години това си ям и нищо ми няма”.
Масивите от данни за невровизуализиране на продължителността на живота показват, че функционалната комуникация между мозъчните региони се дестабилизира с възрастта, като този ефект става по-осезаем в края на 40-те години. Но и нещо много по-интересно, този процес се ускорява с инсулиновата резистентност.
Проф. Пароди извършва редица целеви експерименти, които показват, че този биомаркер за стареене на мозъка се модулира в зависимост от консумацията на различни източници гориво. Глюкозата намалява, а кетоните увеличават стабилността на мозъчните мрежи. Резултатите от изследването са добри и лоши. Лошите са, че дестабилизацията настъпва по-рано, отколкто до сега се е смятало. А добрата, че тези процеси са предотвратими или дори обратими, когато мозъкът започне да се захранва с кетони, вместо с глюкоза.
Човешкия мозък е само около 2% от обема на тялото ни, но пък изразходва около 20% от енергията. Поради тази причина той е особено уязвим от всяка промяна в метаболизма ни. Промяната в начина ни на хранене през последните 100 години увеличи значително гликемичния товар върху тялото, като доведе до епидемия от инсулинова резистентност.
Например, пост-хок анализ на британското кохортно проучване Уайтхол II обобщава, че тези с диабет показват 45% по-бърз спад в паметта, 29% по-бърз спад в разсъжденията и 24% по-бърз спад в глобалната когнитивна оценка и че рискът от ускорен когнитивен спад при пациенти на средна възраст с диабет тип 2 (инсулинова резистентност) зависи както от продължителността на заболяването, така и от гликемичния контрол. Подобни резултати се отчитат при използване на кохорти, получени от Израел и Съединените щати, последният от които установява, че връзката между диабет тип 2 и когнитивната дисфункция е очевидна дори при по-младите.
Мозъчната невровизуализация (fMRI), използвана в това проучване показва, че инсулиновата резистентност блокира способността на невроните да метаболизират ефективно глюкозата в мозъка.
За да бъде тествана реакцията на мозъка към диетата участниците в проучването прекарват една седмица на стандартна (неограничена от въглехидрати) диета и една на ниски въглехидрати. В стандартната диета основното метаболизирано гориво е глюкозата, докато при диета с ниско съдържание на въглехидрати основното метаболизирано гориво са кетони. За да се изолират ефектите от глюкозата и кетоните от другите разлики в диетата се прави и независим избор от участници, предварително сканиран преди и след изпиването на малка доза глюкоза или кетони. Резултатите и в двете групи са идентични, които показват, че ефектите идват от вида гориво, което достига до мозъка, а не от определен тип храна.
Всичко за кето храненето на едно място
В резултат от изследването се стига до извода, че диетичната кетоза повишава общата мозъчна активност и стабилизира функционалните мрежи. Смята се, че причината е факта, че кетоните осигуряват повече енергия на клетките от глюкозата. Този ефект е отдавна проучен и доказан по отношение на сърцето. Но проучването на проф. Пароди е на практика първия експеримент, който представя доказателства за еквивалентен ефект на кето храненето и върху мозъка.
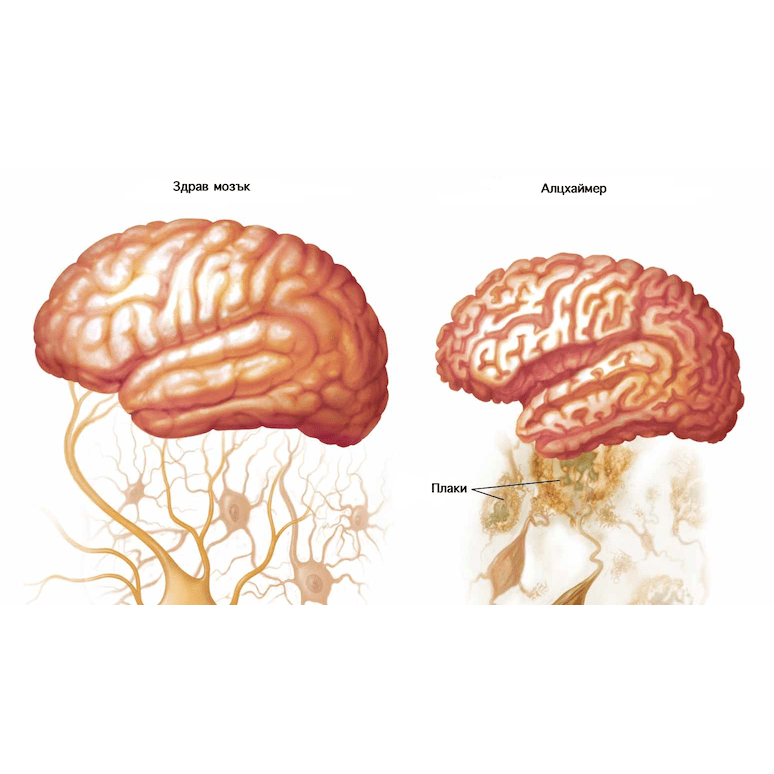
И накрая, фокусът ни върху острите ефекти на модулиращия източник на гориво, контролиран за ролята на няколко потенциални механизма, свързани с различията, наблюдавани в мащабни епидемиологични проучвания, сравняващи диетите. Например, се предполага, че инсулиновата резистентност индиректно улеснява съдовата деменция, тъй като хипергликемията увеличава възпалението и блокира азотния оксид , като по този начин ефективно стеснява мозъчната васкулатура, като същевременно увеличава вискозитета на кръвта. По отношение на болестта на Алцхаймер, последните резултати идентифицират разграждащия инсулин ензим като играеща критична роля за отстраняването на излишния инсулин и амилоид β-протеин от мозъка. Тъй като инсулинът и протеинът се конкурират помежду си за един и същ ензим, едно от последствията от поддържаните високи нива на инсулин, свързани с инсулинова резистентност, е изчерпване на ензима и следователно натрупано отлагане на β-амилоидна плака.
В допълнение, доказано е, че кетоните намаляват възпалението и производството на реактивни кислородни видове, както и за регулиране на митохондриите в мозъка. Въпреки че всичко това може да има значителни кумулативни и синергични ефекти през месеците или годините, предшестващи когнитивното увреждане, поразително е колко бързо мозъкът реагира на една седмица на промяна в диетата или 30 минути след еднократна доза D-βHb. Този бърз отговор ефективно изключва индиректните възпалителни, антиоксидантни, тау (амилоидни) и/или адаптивни митохондриални механизми на действие, което ни позволява да изолираме по-пряката роля на диетата върху метаболизма. Докато ще бъдат необходими допълнителни експерименти за изясняване на механизма в микроскопичен мащаб и за изследване на неговото въздействие върху застаряващия мозък през по-дълги периоди от време, почти незабавните промени в стабилността на мрежата, ясно видими дори в мащаба на единствения участник, са окуражаващи , тъй като те предполагат, че диетичните интервенции могат да имат забележими и измерими невробиологични ефекти върху времевите размери, свързани с клиничната интервенция.







Оставете коментар